Учебная работа. Доклад: Строение атома
Электрон имеет двоякую (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь лишь строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, владеющие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов — очень 2n2
. Энерго уровни разделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.
Квантовые числа электронов.
состояние всякого электрона в атоме обычно обрисовывают при помощи 4 квантовых чисел: головного (n), орбитального (l), магнитного (m) и спинового (s). 1-ые три охарактеризовывают движение электрона в пространстве, а 4-ое — вокруг своей оси.
основное квантовое число (n).
Описывает энергетический уровень электрона, удаленность уровня от ядра, размер электрического облака. Воспринимает целые значения (n = 1, 2, 3 …) и соответствует номеру периода. Из повторяющейся системы для хоть какого элемента по номеру периода можно найти число энергетических уровней атома и какой энергетический уровень является наружным.
Пример.
Элемент кадмий Cd размещен в 5-ом периоде, означает n = 5. В его атоме электроны раcпределены по 5 энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); наружным будет 5-ый уровень (n = 5). Орбитальное квантовое число (l)
охарактеризовывает геометрическую форму орбитали. Воспринимает
Для
l=0 s- подуровень, s- орбиталь — орбиталь сфера
l=1 p- подуровень, p- орбиталь — орбиталь гантель
l=2 d- подуровень, d- орбиталь — орбиталь сложной формы
f-подуровень, f-орбиталь — орбиталь еще наиболее сложной формы
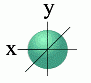
S — орбиталь
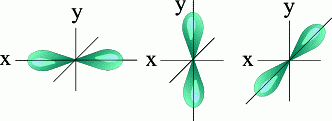
Три p — орбитали
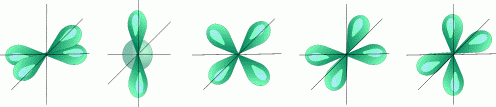
5 d — орбиталей
На первом энергетическом уровне (n = 1) орбитальное квантовое число l воспринимает единственное один подуровень — 1s. Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь — сфера большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь — гантель. Таковым образом, на втором энергетическом уровне имеются два подуровня — 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число l воспринимает три значения: l = 0, s- орбиталь — сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь — гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной формы.
Таковым образом, на 3-ем энергетическом уровне могут быть три энергетических подуровня — 3s, 3p и 3d.
Магнитное квантовое число (m)
охарактеризовывает положение электрической орбитали в пространстве и воспринимает целочисленные значения от -I до +I, включая 0. Это значит, что для каждой формы орбитали существует (2l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь различные ориентации в пространстве.
Для p- орбитали (l = 1) — три равноценные ориентации в пространстве (2l + 1 = 3): m = -1, 0, +1.
Для d- орбитали (l = 2) — 5 равноценных ориентаций в пространстве (2l + 1 = 5): m = -2, -1, 0, +1, +2.
Таковым образом, на s- подуровне — одна, на p- подуровне — три, на d- подуровне — 5, на f- подуровне — 7 орбиталей.
Спиновое квантовое число (s)
охарактеризовывает магнитный момент, возникающий при вращении электрона вокруг собственной оси. Воспринимает лишь два значения +1/2 и -1/2 надлежащие обратным фронтам вращения.
Принципы наполнения орбиталей.
1. Принцип Паули. В атоме не быть может 2-ух электронов, у каких значения всех квантовых чисел (n, l, m, s) могли быть схожи, т.е. на каждой орбитали может находиться не наиболее 2-ух электронов (c обратными спинами).
2. правило Клечковского (принцип меньшей энергии). В главном состоянии любой электрон размещается так, чтоб его энергия была малой. Чем меньше сумма (n + l), тем меньше энергия орбитали. При данном значении (n + l) меньшую энергию имеет орбиталь с наименьшим n. Энергия орбиталей увеличивается в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
3. правило Хунда. Атом в главном состоянии обязан иметь очень вероятное число неспаренных электронов в границах определенного подуровня.
Полная электрическая формула элемента.
Запись, отражающая распределение электронов в атоме хим элемента по энергетическим уровням и подуровням, именуется электрической конфигурацией этого атома. В главном (невозбужденном) состоянии атома все электроны удовлетворяют принципу малой энергии. Это означает, что поначалу заполняются подуровни, для которых:
1) основное квантовое число n мало;
2) Снутри уровня поначалу заполняется s- подуровень, потом p- и только потом d- (l мало);
3) Наполнение происходит так, чтоб (n + l) было мало (правило Клечковского);
4) В границах 1-го подуровня электроны размещаются таковым образом, чтоб их суммарный спин был максимален, т.е. содержал наибольшее число неспаренных электронов (правило Хунда).
5) При заполнении электрических атомных орбиталей производится принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не наиболее чем 2n2
электронов, расположенных на n2
подуровнях.
Пример.
Цезий (Сs) находится в 6 периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням. Cоблюдая последовательность наполнения электронами орбиталей получим:
55
Cs 1s2
2s2
2p6
3s2
3p6
4s2
4p6
4d10
5s2
5p6
5d10
6s1
]]>

 (5 оценок, среднее: 4,80 из 5)
(5 оценок, среднее: 4,80 из 5)